
影响因子:10.7
伯豪技术服务产品:单细胞转录组测序、伯优®单细胞测序组织/细胞保存液
导语
研究背景:NK细胞在固有免疫和适应性免疫中均有重要的作用,Mn2+激活cGAS-STING通路,但该机制对NK细胞的影响尚不明确。
科学问题:Mn2+如何调控NK细胞的激活。
实验材料:C57BL/6小鼠、NK-92MI细胞系、人类和小鼠的原代NK细胞。
表型:Mn2+处理显著抑制小鼠黑色素瘤生长,且NK细胞在这一过程中受到Mn2+调控。
机制:Mn2+激活NK细胞中的cGAS-STING通路,激活UTX的表达,提升NK细胞的响应,直接增强NK细胞的细胞毒性和细胞因子分泌,并通过NK细胞间接激活CD8+ T细胞。
主要技术
单细胞转录组测序
(技术服务由伯豪生物提供)
研究结果
1. Mn2+的抗肿瘤效应依赖于NK细胞
作者通过向C57BL/6小鼠中注射小鼠黑色素瘤细胞B16F10,构建肿瘤模型,分四次腹腔注射MnCl2,观察到Mn2+处理显著抑制肿瘤生长,NK细胞、CD8+T细胞等均有显著增加,NK细胞具有更强的抗肿瘤活性(Fig. 1A-D, S1A, B)。
为了探究Mn2+抗癌的主要影响因素,作者设计了Rag1全身性敲除(Rag1-/-)的免疫缺陷性小鼠,阻断T细胞和B细胞的发育和分化。在排除了T细胞和B细胞的影响后,Mn2+的抗肿瘤能力依旧显著强于对照组,另一方面,Mn2+处理组中的NK细胞的激活水平也显著高于对照组(Fig. 1F, G)。在使用NK细胞抑制剂处理后,肿瘤生长显著上调,而Mn2+的抗肿瘤效应下调(Fig. 1H, I, J)。回补Mn2+,有部分CD8+ T细胞受到激活,肿瘤的生长因此受到部分抑制(Fig. 1I, J, K)。如上结果暗示了NK细胞在Mn2+介导的抗肿瘤效应中发挥的关键性作用,以及Mn2+在此过程中还可能通过NK依赖或非依赖的方式激活其他类型的免疫细胞。
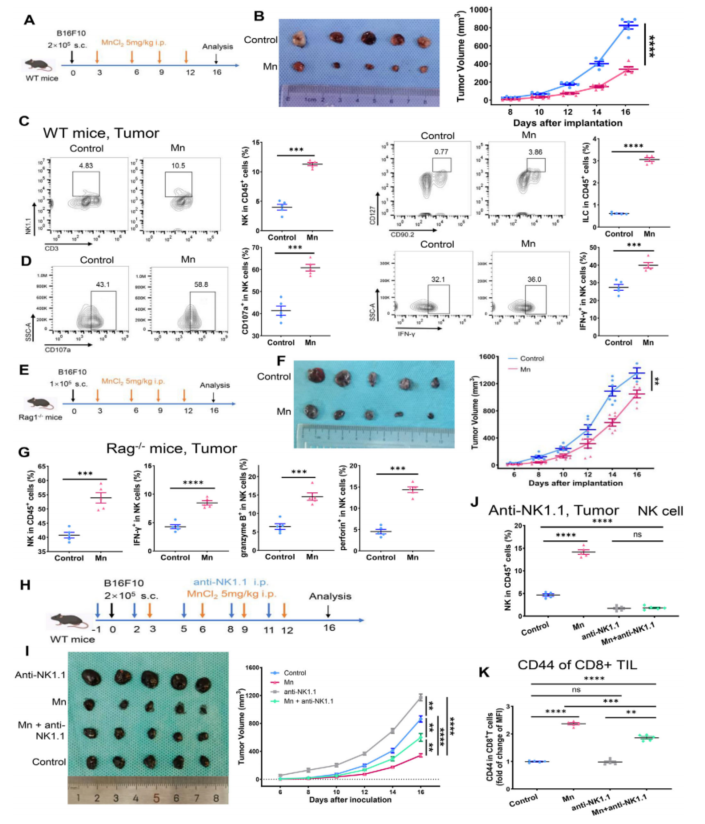
Fig. 1. NK细胞调控Mn2+的抗肿瘤效应
2. Mn2+直接调控NK细胞的细胞毒性
考虑到NK细胞在清除肿瘤细胞过程中发挥的重要作用,作者选择小鼠胰腺和人类PBMC中分离纯化出来的NK细胞,用于探究Mn2+对NK细胞的细胞毒性的调控。结果表明,Mn2+处理不会对NK细胞的生长和凋亡产生显著性的影响,但能使得NK细胞激活marker的表达水平上调(Fig. 2A-F)。
随后,作者选取NK-92MI细胞系和人类原代NK细胞,与靶细胞K562分别以不同的细胞比例(E:T)进行共培养48小时,可见两种NK细胞的Mn2+处理组的细胞毒性均有显著上调,鼠源NK细胞和靶细胞同理可证,即Mn2+提高NK细胞的肿瘤杀伤性(Fig. 3A-H)。
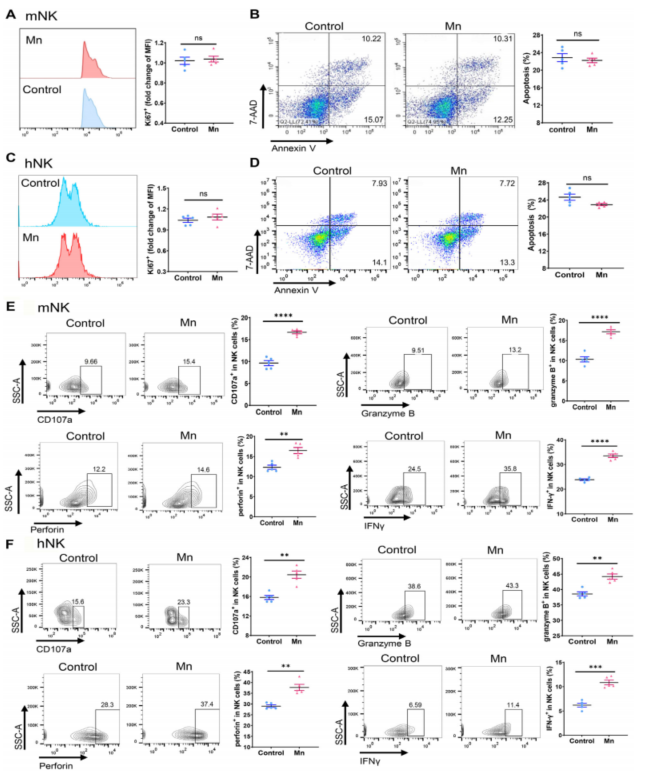
Fig. 2. Mn2+增强NK细胞的激活水平
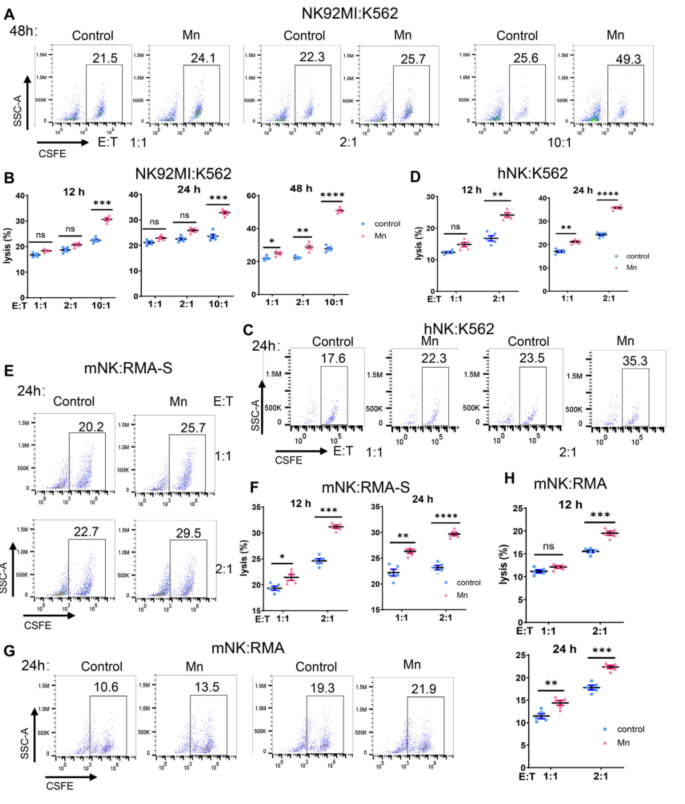
Fig. 3. Mn2+直接增强NK细胞对肿瘤的细胞毒性
3. Mn2+通过NK细胞增强CD8+ T细胞的激活
前文提到,Mn2+的抗肿瘤效应除了可能依赖于对NK细胞细胞毒性的直接调控外,还可能通过NK细胞进一步调控T细胞。为了验证这种可能性,作者检测了NK细胞去除的小鼠中CD8+ T细胞的激活水平,发现Mn2+处理可以让CD8+ T细胞激活水平显著上调但低于对照组(Fig. 1K)。作者分析了CD45+ 肿瘤浸润细胞的单细胞转录组测序(scRNA-seq;测序服务由伯豪生物提供)数据,发现Mn2+处理组中NK细胞、CD8+ T细胞及其他一些细胞类型在数目和比例上显著增加,GO和KEGG富集到了NK细胞中趋化因子和白细胞迁移等与表型和功能相关通路的显著激活,随后用体外实验验证了趋化因子浓度在Mn2+处理条件下的变化(Fig. 4A-F)。在Mn2+处理条件下,CD8+ T细胞和NK细胞共培养时,其激活水平和细胞毒性相比于无Mn2+组均有进一步的显著提升(Fig. 4G-L)。综上,作者得到结论:Mn2+处理可以通过NK细胞依赖或非依赖的方式调控CD8+ T细胞。
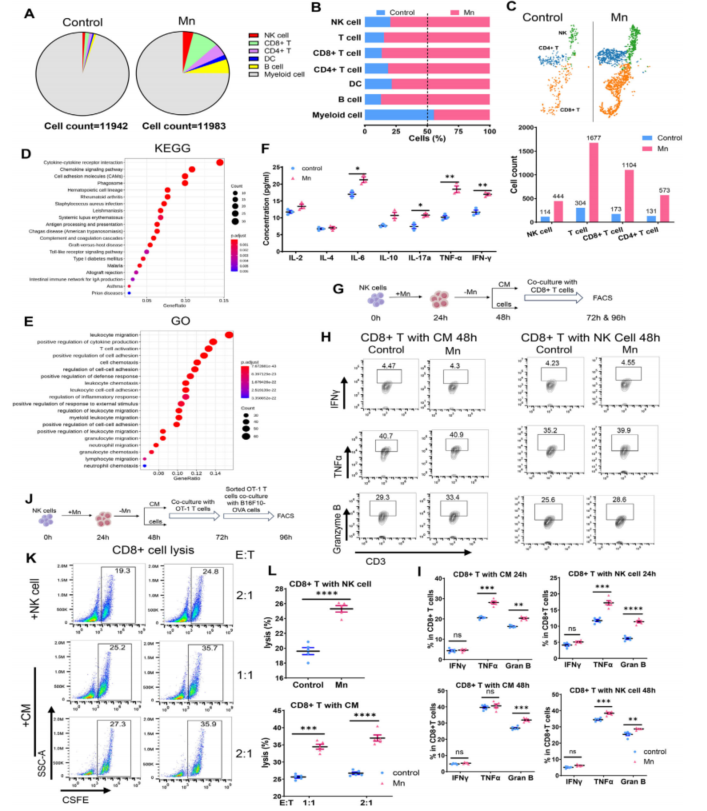
Fig. 4. Mn2+通过NK细胞激活CD8+ T细胞
4. Mn2+通过cGAS-STING-UTX途径激活NK细胞
cGAS-STING途径在以往的研究中已经被报道受到Mn2+调控[1][2][3],UTX也被报道在NK细胞响应中具有重要的作用[4],而本研究中关于Mn2+调控NK细胞的结果也就成为了连接上述两个结论的关键。
首先,作者在STING全身性敲除的小鼠(STING-/-)中验证了NK细胞的增殖和凋亡都不受Mn2+调控,且完全不会被Mn2+处理激活;其次,作者在野生型小鼠中分别利用cGAS和STING的抑制剂对cGAS-STING信号通路进行抑制,观察到Mn2+处理不会影响NK细胞的增殖,但NK细胞的激活水平不再受Mn2+处理的显著上调(Fig. 5)。
最后,为了验证UTX在Mn2+依赖的NK细胞激活调控机制中发挥的作用,作者在scRNA-seq结果中通过在转录水平上计算cGAS和STING的表达水平与UTX表达水平之间的相关系数,推断出cGAS-STING通路与UTX具有显著的相关性,并使用TCGA数据库中的公共数据对这一结论进行了验证,随后进一步通过公共数据发现了UTX转录水平和NK细胞丰度之间具有显著的正相关性(Fig. 6A, B)。
Mn2+处理能在转录和翻译水平上调UTX,但这种调控在STING敲除的NK细胞中受到明显的抑制(Fig. 6C, D)。在cGAS或STING抑制剂处理的NK细胞中过表UTX可以显著回补激活的NK细胞占比,反之亦然(Fig. 6E-H)。
综上,作者验证了Mn2+依赖的cGAS-STING-UTX通路调控NK细胞激活的机制。
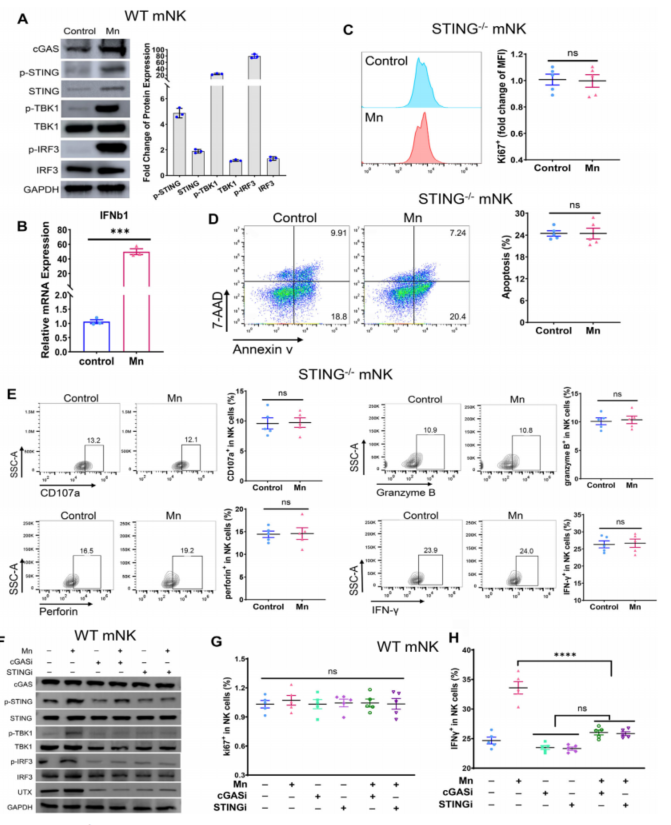
Fig. 5. Mn2+通过NK细胞固有的cGAS-STING途径激活NK细胞
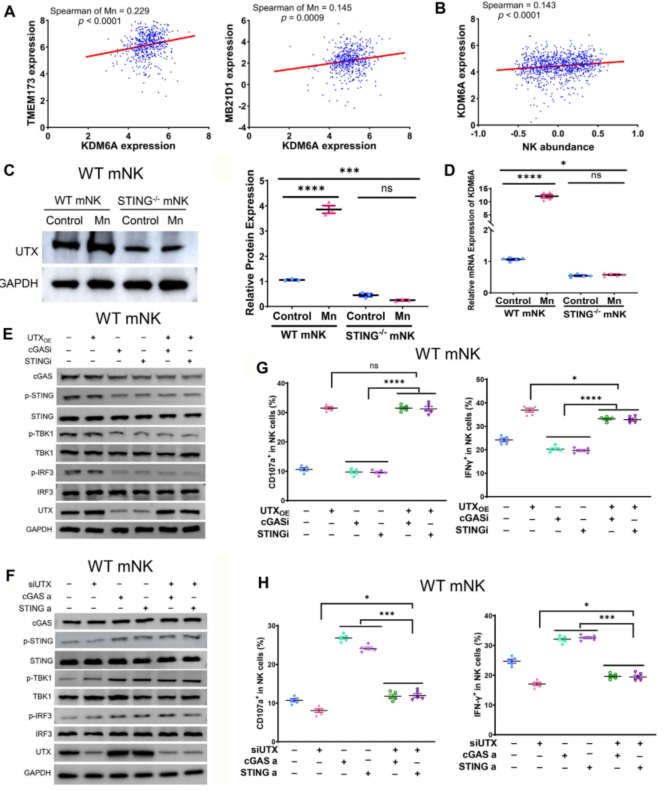
Fig. 6. Mn2+通过STING诱导UTX表达进而激活NK细胞
参考文献:
[1]. Hooy RM, Massaccesi G, Rousseau KE, Chattergoon MA, Sohn J. Allosteric coupling between Mn2+ and dsDNA controls the catalytic efficiency and fidelity of cGAS. Nucleic Acids Res. 2020;48(8):4435-4447.
[2]. Wang C, Guan Y, Lv M, et al. Manganese increases the sensitivity of the cGAS-STING pathway for double-stranded DNA and is required for the host defense against DNA viruses. Immunity. 2018;48(4).
[3]. Zhao Z, Ma Z, Wang B, Guan Y, Su X-D, Jiang Z. Mn2+ directly activates cGAS and structural analysis suggests Mn2+ induces a noncanonical catalytic synthesis of 2’3’-cGAMP. Cell Rep. 2020;32(7):108053.
[4]. Cheng MI, Li JH, Riggan L, et al. The X-linked epigenetic regulator UTX controls NK cell-intrinsic sex differences. Nat Immunol. 2023;24(5):780-791.
