
编者按
转化生长因子β(TGF-β)是分泌型二聚体细胞因子多功能家族的原型成员,TGF-β信号通路的每一步都受到精确控制,并与其他信号通路串扰。上皮-间充质转化(EMT)是一种动态且可逆的形态过程,是胚胎发育[1](Nakajima等人,2000)和伤口愈合[2](Barriere等人,2015)过程中的瞬时和可逆的关键过程。此外,它在病理过程中起着重要作用,特别是在癌症进展和纤维化中[3-4](Zeisberg等人,2007;Derynck&Weinberg,2019年)。TGF-β是EMT的有效诱导剂[5](Derynck等人,2014)。鞘糖脂(GSL)是在细胞膜中发现的主要一类糖脂。
今天,我们特别关注一项2022年12月由荷兰莱顿大学医学中心蛋白质组学和代谢组学中心研究团队在EMBO J(IF=11.4)上发表的研究成果,该研究构建了斑马鱼异种移植模型,并利用小鼠正常乳腺上皮NMuMG细胞和人肺上皮腺癌A549细胞,通过分析糖组学平台研究GSLs在TGF-β诱导的EMT中的改变和作用,结果表明,通过失活糖基转移酶UGCG来抑制GSL表达可促进TGF-β信号传导和TGF-β诱导的EMT;在TGF诱导的EMT期间,这两种细胞系中的GSLsβ显着降低,催化A系列神经节苷脂合成的ST3GAL5抑制了TGF-β信号转导反应。这些神经节苷脂被发现可以确定TβRI在脂筏中的定位并控制其泛素化和周转。值得注意的是,研究者发现ST3GAL5在肺癌组织中的表达水平远低于在邻近正常组织中的表达水平,并且其表达与肺癌患者的良好预后相关。
文章题目
ST3GAL5‐catalyzed gangliosides inhibit TGF‐β‐induced epithelial‐mesenchymal transition via TβRI degradation
杂志:EMBO JOURNALEMBO J(IF=11.4)
发表时间:2022.12.12
作者:Jing Zhang, Tao Zhang, Peter ten Dijke等
单位:荷兰莱顿大学医学中心蛋白质组学和代谢组学中心等
01、研究结果
1. TGF‐β抑制NMuMG和A549‐VIM-RFP细胞中神经节苷脂的表达
为了研究TGF-β诱导的接受EMT的细胞中GSL-聚糖的变化,研究者们选择了两种具有显着TGF-β诱导的EMT反应的成熟细胞模型,即NMuMG(Zhang等人,2020a)和A549-波形蛋白(VIM)-红色荧光蛋白(RFP)细胞系(Wang等人,2020)。
结果显示,在TGF-β刺激的A549-VIM-RFP细胞中观察到GSLs的绝对丰度大幅下降,用TGF-β刺激NMuMG和A549-VIM-RFP细胞可显著降低ST3GAL5蛋白表达。此外,TGF-β降低了NMuMG细胞中B4galnt1、B5galt6和St3gal5的基因表达水平,这些必需酶催化神经节苷脂的形成。
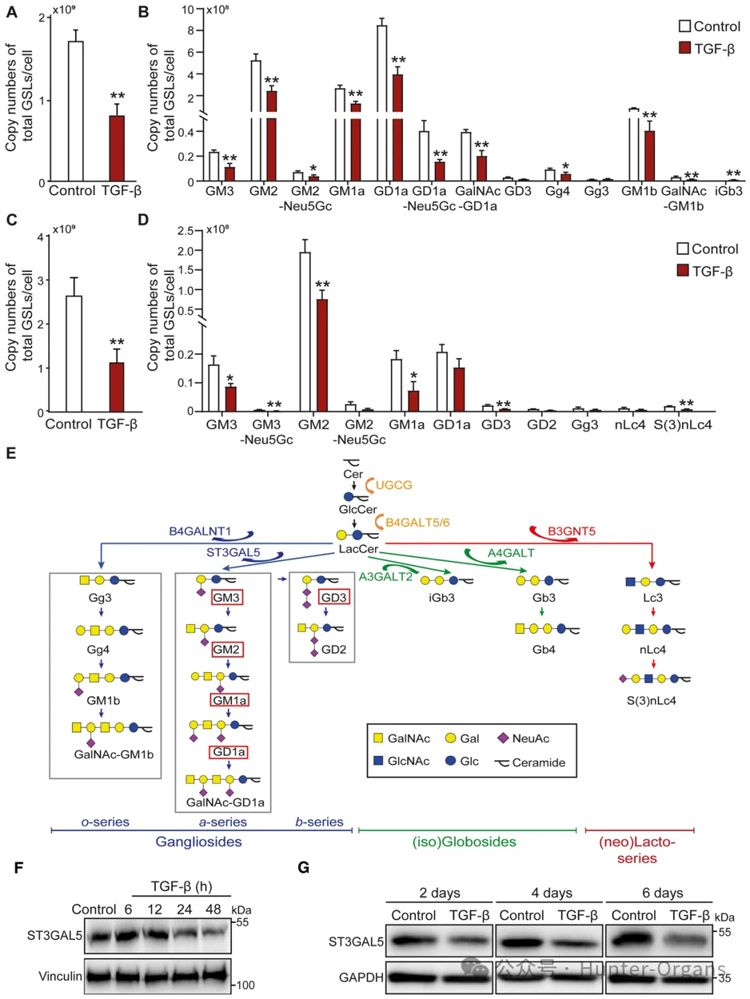
图1
2. UGCG敲除导致NMuMG细胞中TGF-β信号转导和TGF-β诱导的EMT的增强
糖基转移酶UGCG是启动复杂GSL结构合成途径的第一种酶,为了研究GSLs在TGF-β信号传导中的作用,研究者通过基因编辑生成UgcgNMuMG敲除(KO)细胞,进行UGCG酶活性测定、CTB和FACS分析、糖组分析和单个GSL绝对丰度的定量分析、RNA测序(RNA-seq)、基因集富集分析(GSEA)证实了UGCG介导TGF-β信号传导抑制的假设。
随后,研究者检查了Ugcg耗竭对NMuMG细胞中TGF-β诱导的反应和EMT标志物表达水平的影响。结果进一步验证了TGF-β诱导EMT增强。EMT的激活可以使细胞迁移能力增强。因此,研究者进一步研究了NMuMG细胞中UgcgKO的基础迁移率。与对照细胞相比,具有Ugcg耗竭的NMuMG细胞显示出迁移增强。综上所述,UGCG是NMuMG细胞中TGF-β/SMAD信号转导和EMT的关键抑制剂。
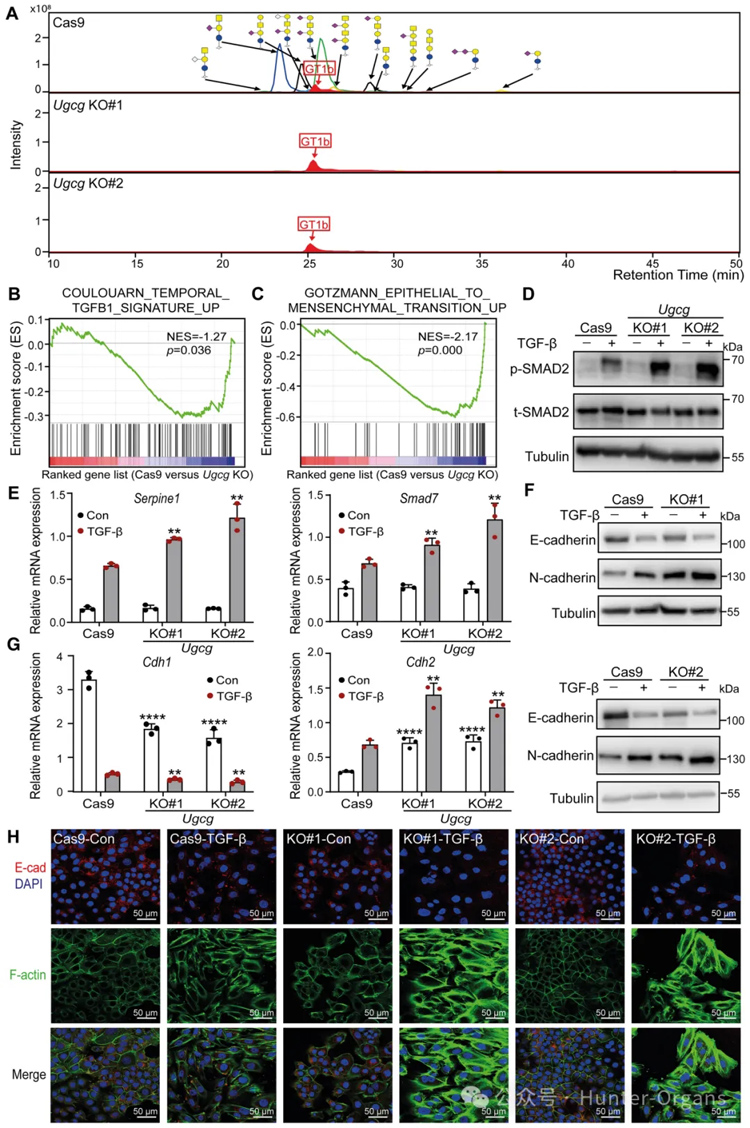
图2
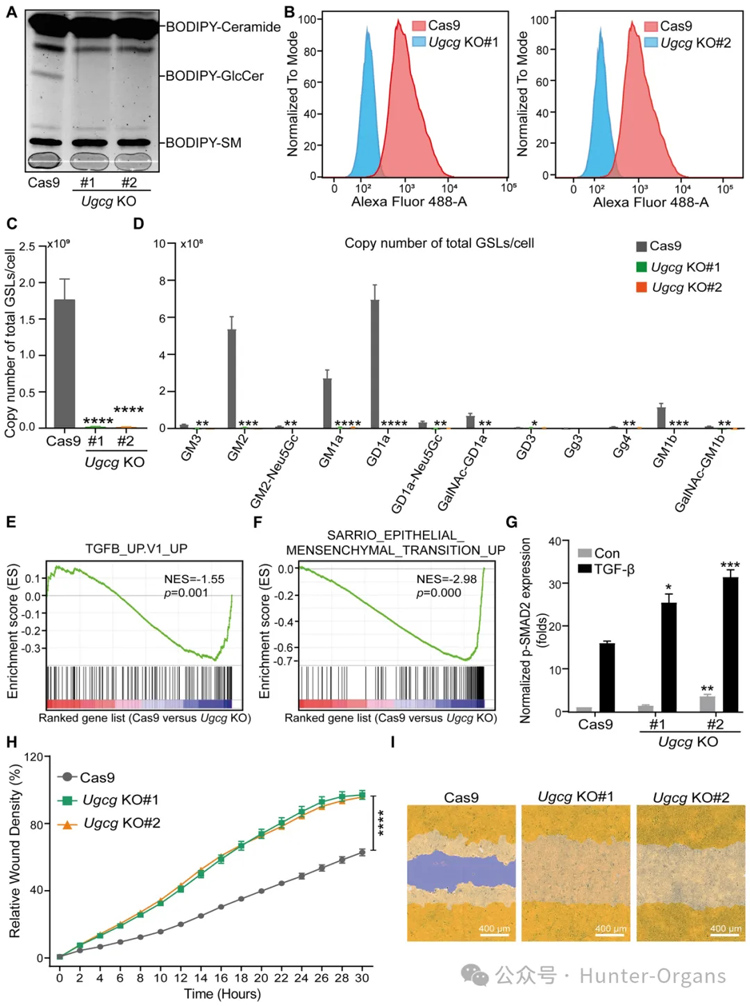
图3
3. Eliglustat是一种UGCG活性抑制剂,可促进TGF-β信号传导、TGFβ诱导的EMT、细胞迁移、外渗和早期转移性生长
研究者们通过通过使用FACS分析测量GM1表达来证实eliglustat作为UGCG抑制剂的有效性;qRT-PCR分析证实,eliglustat通过增加TGF-β靶基因(包括SMAD7、SERPINE1和CCN2)的表达水平来促进TGF-β信号转导;通过RFP标记的波形蛋白表达的动态增加和F-肌动蛋白形成的增强,进一步证实了eliglustat介导的TGF-β诱导的EMT的促进;通过划痕测定证明eliglustat处理增强了基础和TGF-β诱导的细胞迁移。
此外,添加SB505124完全阻断了eliglustat诱导的细胞迁移促进,表明eliglustat诱导的细胞迁移需要TβRI信号传导。基于此,研究者使用斑马鱼异种移植模型系统研究了eliglustat对A549细胞外渗的影响;通过尾静脉将A549-Luc细胞注射到裸鼠体内,研究了eliglustat对A549-Luc细胞转移能力的影响。数据表明,UGCG和UGCG定义的GSL抑制小鼠上皮NMuMG细胞和人肺癌A549细胞中的TGF-β信号传导和EMT,以及A549细胞的迁移、外渗和转移。
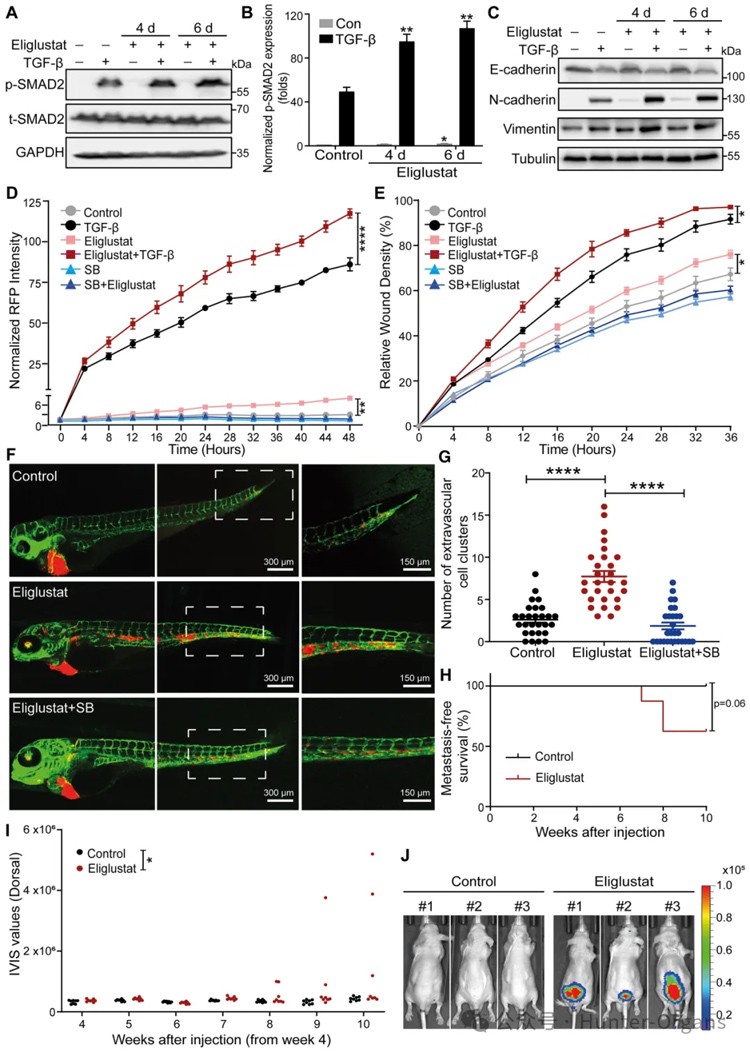
图4

图5
4. 抑制GSL生物合成可降低TβRI在脂筏中的定位,保护TβRI免受泛素化并增加其稳定性
鞘糖脂被发现可以通过促进脂筏或小窝膜中膜锚定分子之间的横向相互作用来影响信号转导,为研究GSLs控制TGF-β受体信号转导和TGF-β-receptor诱导的EMT机制,研究者通过免疫印迹分析,专门检查细胞表面TβRI池,可观察到用eliglustat处理的A549-VIM-RFP细胞中的细胞表面TβRI水平显着增加。因此,研究者研究了抑制GSL合成是否会影响TβRI在质膜中脂筏和非脂筏微结构域之间的分配,结果显示GSL生物合成减少会降低脂筏组分中的TβRI水平。
此外,研究者研究了eliglustat对TβRI泛素化的影响、eliglustat在调节TβRI稳定性中的作用,这些结果表明,从机制上讲,GSL诱导的TGF-β信号转导抑制是由于有利于TβRI在脂筏中的定位而引起的,从而触发其泛素化和随后的降解。
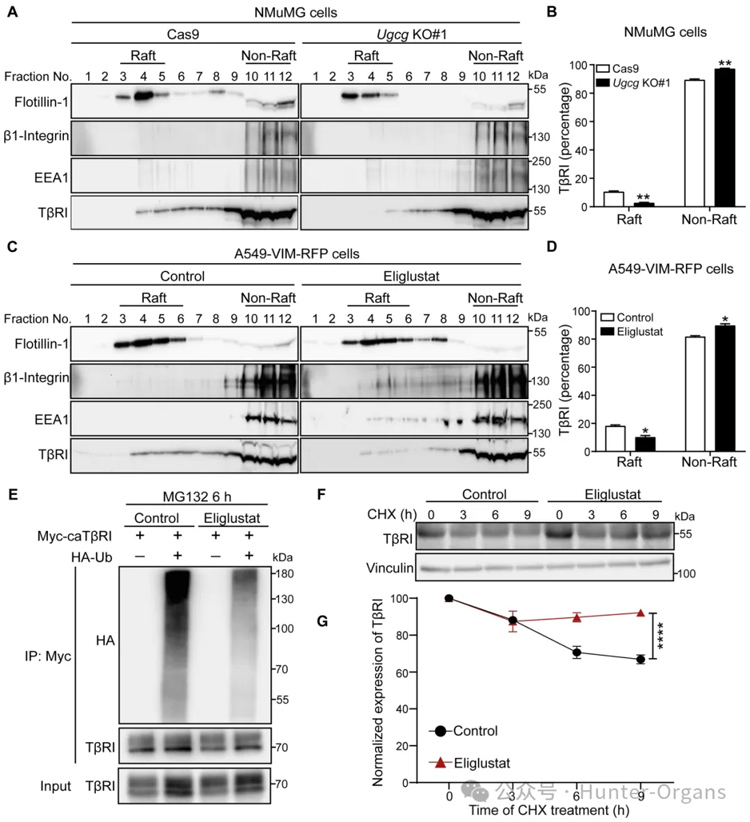
图6
5. ST3GAL5介导的A系列神经节苷脂生物合成抑制TGFβ信号传导和TGFβ诱导的EMT
使用PGCnano-LC-ESI-MS/MS对缺乏ST3GAL5或B4GALNT1的细胞进行糖组分析证实了这两种酶产生的特定神经节苷脂产物的大幅减少。ST3GAL5敲低细胞的GM3、GM2和GM1a显著降低,与TGF-β处理后的结果一致。然而,B4GALNT1敲除导致总GSL水平与TGF-β对神经节苷脂水平的影响非常不同。
接下来,研究者研究了ST3GAL5和B4GALNT1敲低对A549细胞中TGF-β信号传导和EMT的影响。结果证明ST3GAL5的异位表达通过下调TGF-β诱导的SMAD2磷酸化和SMAD3依赖性CAGA-GFP报告基因活性,以及降低TGF-β/SMAD靶基因的转录水平来抑制TGF-β信号通路。TGF-β诱导的EMT也被ST3GAL5过表达所抑制。所有这些结果都表明,ST3GAL5而非B4GALNT是TGF-β信号传导和TGF-β诱导的EMT的关键参与者。
ST3GAL5催化LacCer转化为GM3,GM3是前体神经节苷脂,用于延伸和进一步支化反应,产生a系列神经节苷脂以及b系列神经节苷脂。两种类型的神经节苷脂在NMuMG和A549细胞中均高表达。接下来,研究者研究了添加外源性神经节苷脂对TGF-β信号转导的影响,发现a系列神经节苷脂处理后的两种细胞对TGF-β诱导的SMAD3依赖性CAGA-GFP报告基因活性表现出显着抑制,而b系列神经节苷脂处理的细胞与对照细胞相比没有变化。此外,a系列神经节苷脂的外源添加消除了TGF-β诱导的间充质标志物的表达,TGF-β诱导的RFP标记波形蛋白表达的促进。此外,在用外源性a系列神经节苷脂刺激后,A549-VIM-RFP细胞在TGF-β处理后表现出比对照细胞更少的F-肌动蛋白形成。综上所述,ST3GAL5合成的a系列神经节苷脂在TGF-β信号传导和TGF-β诱导的EMT中起关键作用。
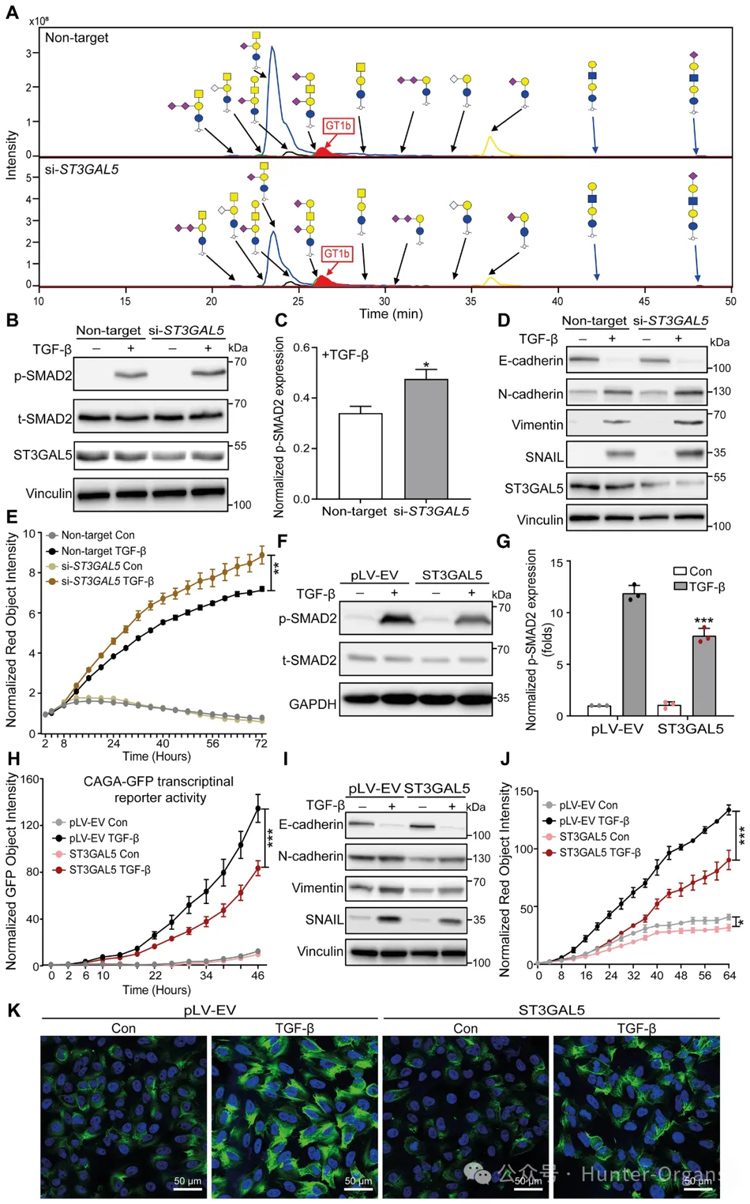
图7

图8
6. ST3GAL5促进SMAD7-SMURF2诱导的泛素化和TβRI降解
接下来,研究者研究了ST3GAL5诱导TGF-β信号传导抑制的机制。由于MDA-MB-231细胞中的内源性TβRI水平远高于NMuMG细胞和A549细胞,因此使用MDA-MB-231细胞系来研究神经节苷脂对TβRI泛素化的影响。研究者观察到,将外源性a系列神经节苷脂(GM1a、GM2或GM3)添加到感染HA-Ub慢病毒的MDA-MB-231细胞中可促进TβRI的泛素化。
此外,GM3诱导的TβRI泛素化增加因SMURF2的敲低而减弱,表明该E3连接酶参与TβRI的泛素化。定量结果显示,GM3处理显著降低了TβRI在细胞表面的表达,并且通过添加蛋白酶体抑制剂MG132或溶酶体抑制剂BafA1减弱了这种作用,表明GM3诱导的TβRI降解是通过蛋白酶体和溶酶体途径介导的。这些结果表明,ST3GAL5催化的a系列神经节苷脂通过降低细胞表面表达和TβRI的稳定性来减轻TGF-β信号转导反应并增加SMURF2诱导的TβRI泛素化。
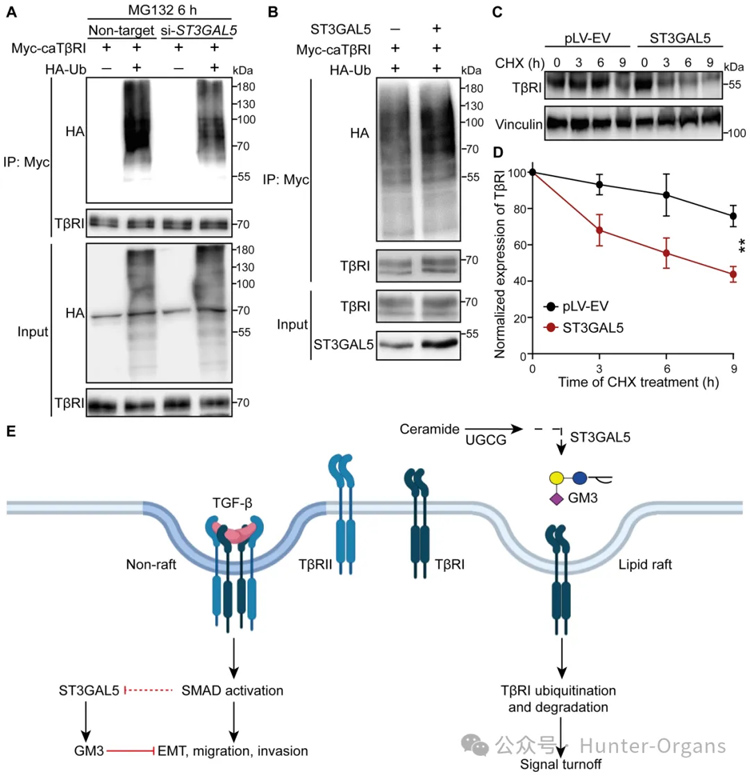
图9
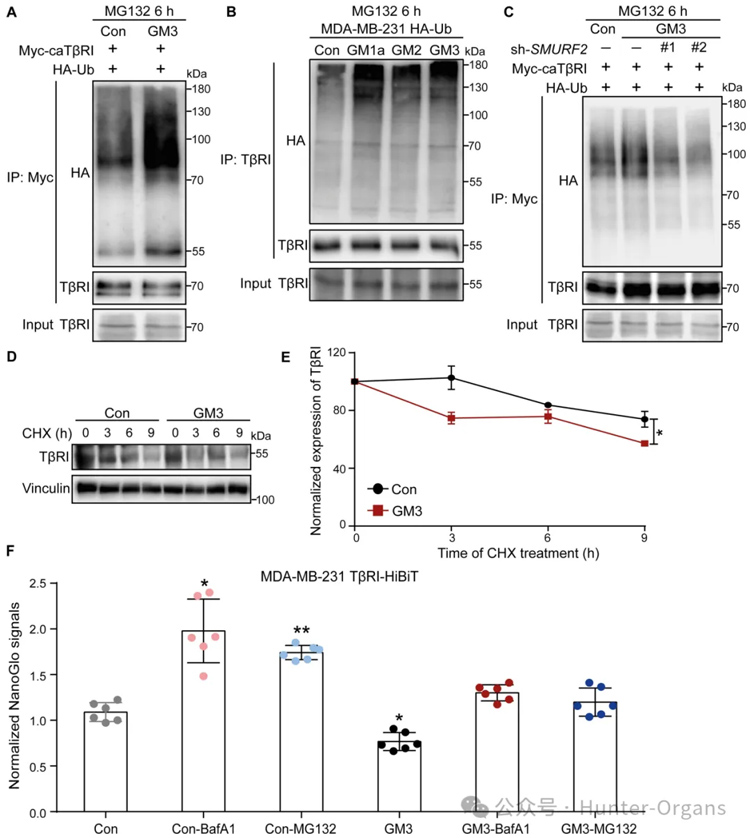
图10
7. ST3GAL5的异位表达抑制A549细胞迁移、侵袭和转移性生长,并与肺癌的良好预后有关
为了研究ST3GAL5和通过其催化活性在A549细胞迁移中产生的神经节苷脂的功能,研究者使用siRNA介导的ST3GAL5敲低或转染对照siRNA对A549细胞进行了划痕测定。ST3GAL5的过表达显著抑制了TGF-β诱导的迁移。此外,添加GM1a、GM2或GM3会降低A549-VIM-RFP细胞在TGF-β刺激下的迁移能力。接下来,研究者分析了肺癌A549细胞中ST3GAL5错误表达对斑马鱼异种移植模型外渗的影响。将ST3GAL5耗竭或过表达的mCherry表达A549细胞注射到斑马鱼胚胎中,注射后4天计数血管外簇。在注射ST3GAL5敲低A549细胞的斑马鱼胚胎组中观察到更多的血管间细胞簇。ST3GAL5的异位表达强烈抑制了斑马鱼模型中A549细胞的外渗。然后,研究者使用注射有或没有ST3GAL5过表达的A549-Luc细胞的5周龄BALB/cnu/nu小鼠来研究ST3GAL5对细胞转移生长能力的影响。结果与其在体外和斑马鱼异种移植模型中的发现一致,即在注射ST3GAL5过表达A549-Luc细胞的小鼠中检测到初始细胞转移的时间晚于注射A549-Luc对照细胞的小鼠。此外,ST3GAL5的异位表达抑制了循环A549细胞的早期转移。
接下来,鉴于ST3GAL5在调节细胞迁移和侵袭中的关键作用,研究者研究了ST3GAL5是否可能是早期肺癌的相关生物标志物。使用982名肺癌患者的公开队列,我们发现ST3GAL5的低表达与首次进展前的生存预后不良有关。此外,研究者通过使用ST3GAL5特异性抗体进行免疫组织化学(IHC)染色,检查了组织微阵列中ST3GAL5蛋白水平,该阵列包含来自50名患者的150个肺癌组织和相邻表型正常组织。与癌症组织相比,ST3GAL5在邻近的正常组织中高表达。总之,这些结果表明,ST3GAL5表达抑制细胞迁移、侵袭和转移,并且与肺癌的良好预后相关。
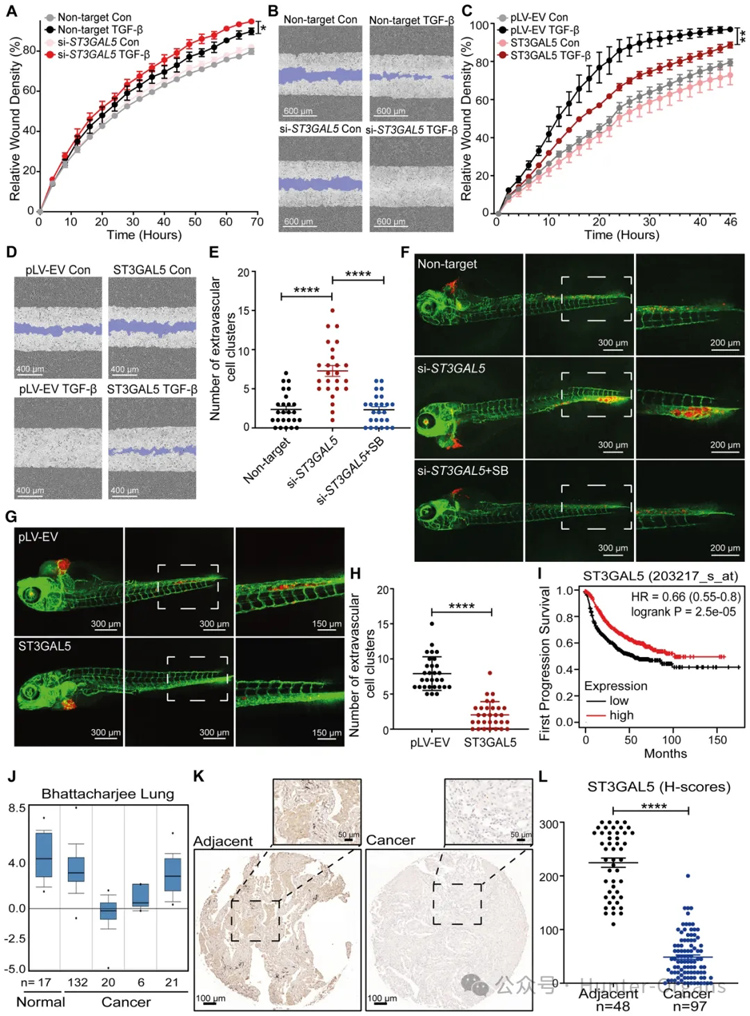
图11
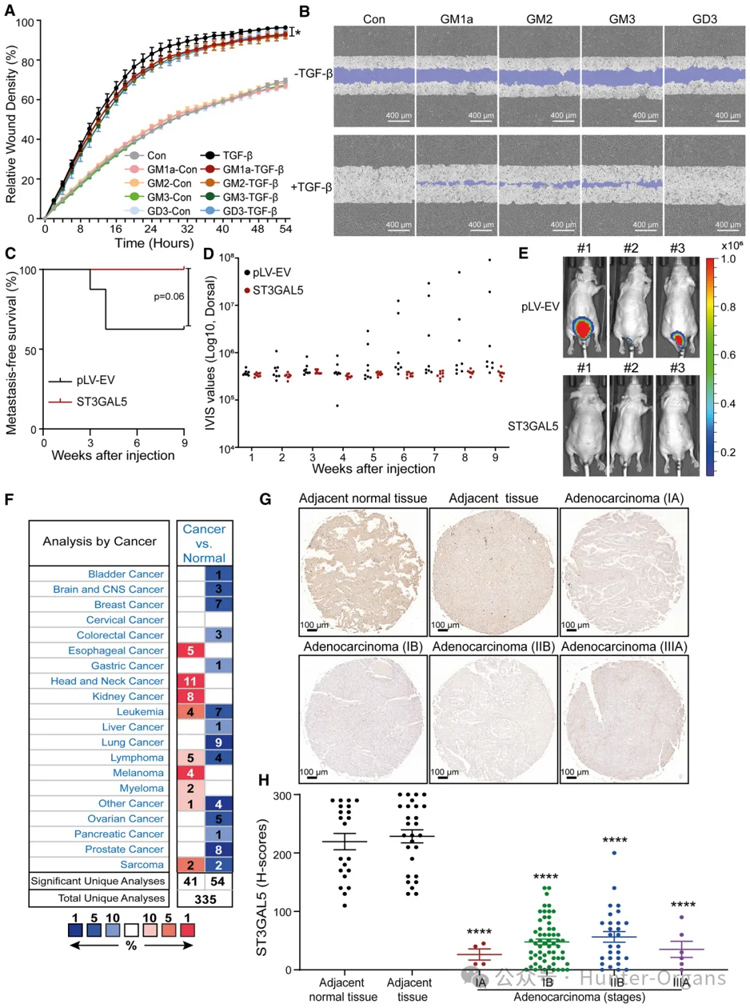
图12
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型及脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!
