
编者按
滤泡性淋巴瘤(FL)是最常见的惰性淋巴瘤,具有临床和遗传异质性。尽管FL在目前治疗的大多数患者中被认为是不可治愈的,但无进展生存期平均超过10年。然而,有一部分经历早期复发的FL患者有明显更高的发病率和死亡率。
今天我们来解读一项2024年2月由美国加利福尼亚大学Lisa E. Wagar和斯坦福大学Ash A. Alizadeh团队发表在Cell Stem Cell(IF=23.90)的最新研究——《A human lymphoma organoid model for evaluating and targeting the follicular lymphoma tumor immune microenvironment》。该研究利用原发性滤泡性淋巴瘤肿瘤活检组织开发了一种患者来源的淋巴瘤类器官模型,证明了在无外源性细胞因子的情况下,3周内可保持体外微环境稳定性。接受双特异性免疫疗法治疗后,类器官再现了T细胞介导的杀伤作用,从而可以研究影响应答的患者特异性微环境决定因素。
文章题目
A human lymphoma organoid model for evaluating and targeting the follicular lymphoma tumor immune microenvironment
杂志:Cell Stem Cell
影响因子:23.90
发表时间:2024年2月
作者及单位:美国加利福尼亚大学Lisa E. Wagar;斯坦福大学Ash A. Alizadeh等
论文翻译:何玲玲
01、研究背景
滤泡性淋巴瘤(FL)是最常见的惰性淋巴瘤,具有临床和遗传异质性。尽管FL在目前治疗的大多数患者中被认为是不可治愈的,但无进展生存期平均超过10年。然而,有一部分经历早期复发的FL患者有明显更高的发病率和死亡率。
免疫逃避是滤泡性淋巴瘤持续存在和进展的一个关键方面,未经治疗的疾病的兴衰性质表明抗肿瘤免疫机制的动态参与。恶性FL克隆与肿瘤微环境(TME)中其他细胞亚群之间的多种相互作用已被确定参与淋巴瘤维持或与临床结果相关。随着新型淋巴瘤免疫疗法的出现,检测和操纵这种动态相互作用的方法变得越来越重要,包括双特异性T细胞参与抗体(双特异性抗体)和细胞治疗、嵌合抗原受体携带T细胞(CAR-T)。这些不同疗法的免疫效应功能需要一个完整的TME,因此很难在传统的体外B细胞单培养中建模。
来自非淋巴器官的类器官系统,包括肺、肠和大脑,在更准确地代表人体组织的TME方面表现出了巨大的潜力。由于免疫细胞发育要求的复杂性和多样性,使用传统的类器官技术生成能够再现免疫TME的类器官一直具有挑战性。
在过去的十年中,先前的研究对体外和体内生物工程技术做出了关键贡献和改进以培养免疫细胞及其相应的TME治疗淋巴瘤,但基本的局限性仍然是一个问题,包括依赖细胞系作为淋巴结或支持细胞的来源、长期培养的潜力尚不清楚、纯小鼠或异种移植物淋巴组织的分析以及对外源性细胞因子的依赖。因此,先前对免疫细胞和TME建模的尝试在其概括人类生理学的能力方面受到限制,并且尚未有助于改善临床前模型的治疗转化。此外,在设计一刀切的疗法时,人类适应性免疫反应和FL疾病在每个患者基础上的固有变异性都增加了另一层复杂性。
一个强大的体外、高通量模型能够使原代患者来源的恶性淋巴细胞在其天然TME中稳定共培养,可以加速我们对FL生物学的理解,包括个性化反应评估。本文中,研究团队创建了来自原发性人类FL活检的淋巴组织样器官,并使用相应的患者源性淋巴瘤类器官(PDLOs)来分析新型免疫疗法的机制基础,包括CD3:CD19和CD3:CD20双特异性抗体治疗。
02、研究结果
1、患者来源性淋巴瘤类器官作为FL TME繁殖的平台,在培养中是可行的和高度稳定的
为了开发和验证滤泡性淋巴瘤的PDLO模型系统,研究团队研究了12例滤泡性淋巴瘤患者的初级活检,包括了在最初FL诊断、最初预期观察、先前全身治疗后疾病复发或侵袭性组织学转化为弥漫大B细胞淋巴瘤时获得的主要淋巴结组织的切除手术活检样本,这些PDLOs在培养体系中可以存活至少21天(图1C),且能够充分维持FL细胞和TME。接下来研究团队评估了PDLOs中恶性淋巴瘤细胞的初始表现和纵向稳定性,发现PDLOs具有受性B细胞受体(BCR)轻链同型的CD3阴性细胞,与患者的临床肿瘤免疫表型相匹配(图1D-E)。
进一步在体外和纵向评估PDLOs中非B细胞群,发现FL TME中大多数非恶性细胞为T细胞群。尽管不同肿瘤之间的总T细胞比例不同,但随着时间的推移,它们在单个PDLO中的表现在组成和频率上是稳定的(图1F);同样地,CD4和CD8 T细胞室在PDLO培养过程中都保持良好(图1G-H)。当关注T滤泡辅助细胞(Tfh)时,之前被描述为FL TME中促进免疫逃避的关键亚群,研究团队证实了CXCR5+PD-1+ Tfh群体在PDLO培养中保持稳定(图1I)。
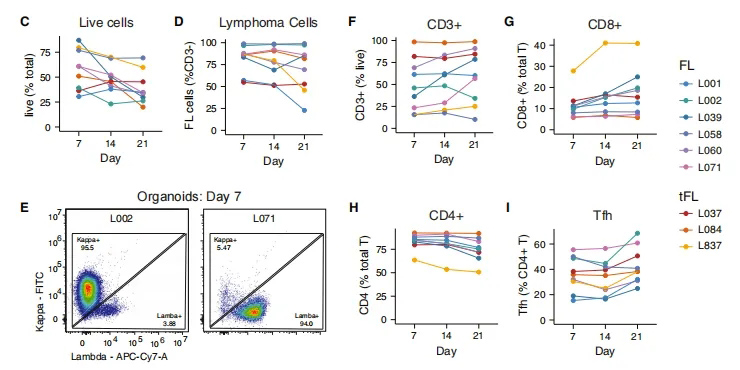
图1
2、PDLOs中的肿瘤B细胞显示出克隆性和突变性的稳定性
为了评估PDLOs在培养过程中的突变稳定性和潜在选择,研究团队使用CAPP-seq来评估培养前(第0天)和每周时间点(第7、14和21天)的错义体细胞突变,确定了在培养3周内,类器官突变谱保持稳定(图2A)。
进一步从RNA-seq数据中评估显性BCR重链和轻链重排,并将其与基线时确定的显性BCR重排进行了比较,发现尽管供体之间BCR限制性B细胞的比例是可变的(与每个患者活检的肿瘤负荷水平一致),但在随后的时间点,大多数供体的肿瘤BCR克隆比例是稳定的((图2B)。
接下来,研究团队评估了培养第7、14和21天的一系列RNA基因表达数据。基因表达谱的无监督聚类显示,来自个体患者的样本存在共聚类,与稳定和患者特异性的TME组成一致(图2C)。发现CREBBP突变与稳定性显著相关(p = 0.014),而TP53突变的病例的稳定性显著降低(p = 0.008,图2D)。总之,流式细胞术和分子分析表明,来自TME的肿瘤和非肿瘤免疫细胞在3周的培养期间是表型、突变和转录稳定的,PDLO技术成功地支持了原代淋巴瘤细胞的长期培养。
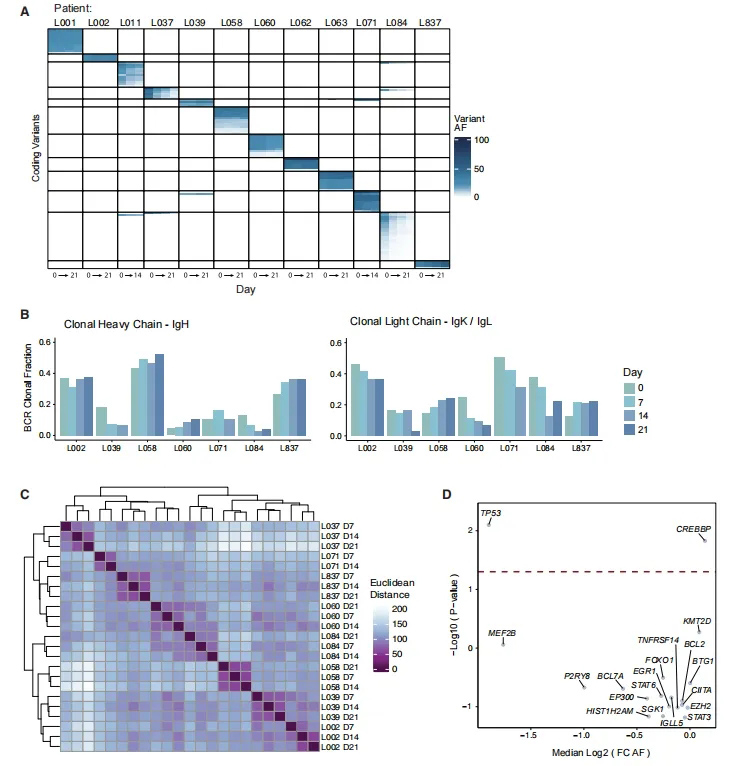
图2
3、PDLOs概括了双特异性免疫参与剂的治疗反应
在证明了PDLOs对恶性肿瘤B细胞及其TME对应细胞的稳定性后,研究团队接下来评估了该平台是否可以用于复制T细胞依赖性免疫治疗反应后的预期扰动。
在有足够的活检材料的情况下,研究团队将CD3:CD19双特异性抗体治疗与相应的未偶联的抗CD19和抗CD3单克隆抗体作为对照,发现未偶联的抗体在PDLOs中的影响很小(图3A)。使用与最初的PDLO表征类似的多模态方法分析双特异性免疫治疗在每个PDLO中的效果(图3A),发现双特异性抗体治疗后7天,CD3:CD19双特异性抗体诱导每个PDLO中的淋巴瘤细胞显著下降(图3B)。
由于双特异性抗体效应机制是T细胞依赖性的,研究团队进一步评估了CD3:CD19抗体治疗后的T细胞群体频率和激活表型,发现总CD4+和CD8+ T细胞比例没有被处理改变(图3C)。对处理和未处理的PDLOs的基因集合富集分析显示,与T细胞介导的免疫应答相关的多种通路上调,包括MAPK通路、PDL1通路和Th17细胞分化(图3F)。考虑到BCR克隆性作为淋巴瘤B细胞的特异性标记物,在CD3:CD19双特异性抗体治疗后,显性单克隆BCR克隆型的频率显著降低,表明靶向双特异性诱导的淋巴瘤细胞杀伤(图3G)。
总之,这些数据表明,CD3:CD19双特异性抗体治疗的疗效可以使用PDLOs在每个患者身上进行测量和表征。
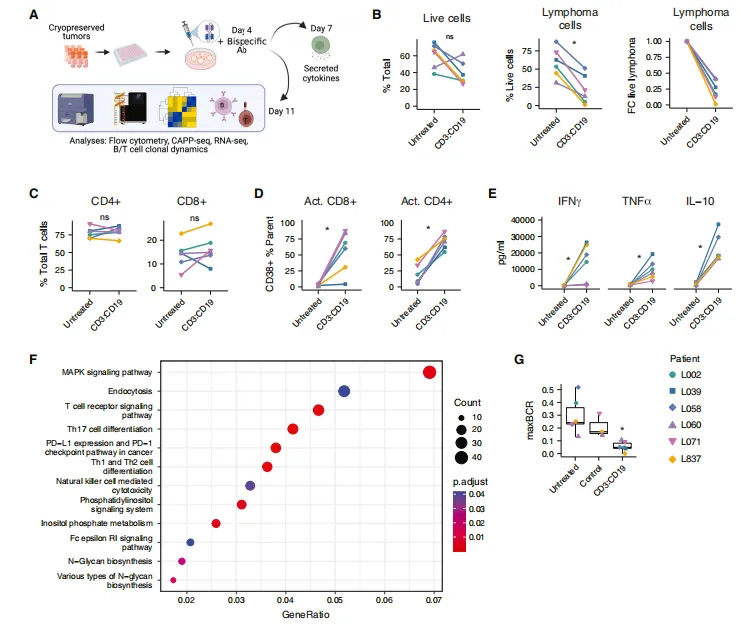
图3
4、PDLOs揭示了有效的双特异性治疗反应的相关性
考虑到PDLOs与B细胞单培养相比的多样性,它们的一个潜在优势是能够评估个体患者反应的相关性。为了评估临床相关的免疫治疗,研究团队使用双特异性抗体治疗相同患者的FL PDLOs,发现CD20:CD3双特异性处理组与相同剂量CD3:CD19双特异性抗体的类似实验相比,诱导B细胞杀伤的幅度降低(图4A);被杀死的淋巴瘤细胞的比例显示反应具有患者特异性和治疗特异性(图4B);与CD3:CD20双特异性抗体相比,CD3:CD19双特异性抗体处理组能够更好地诱导CD4+ T细胞活化(图4D);与CD3:CD20处理相比,CD3:CD19显著诱导了更多的Tfh和非Tfh T细胞活化(图4F)。
研究团队进一步发现,Tfh激活与肿瘤杀伤之间存在显著的正相关关系,而与非TfhT细胞激活之间几乎没有关联(图4G)。转录组学分析进一步显示,CD3:CD19治疗显著诱导了关键的免疫检查点的表达,包括TIGIT、LAG3、CTLA4和PD1(图4H)。与CD3:CD20相比,CD3:CD19处理的培养上清液中细胞因子IFNg、TNF-a和IL-10的含量也更高(图4I)。这些结果似乎与持续的T细胞激活可能诱导衰竭表型相一致,正如之前在持续的双特异性暴露中观察到的那样。
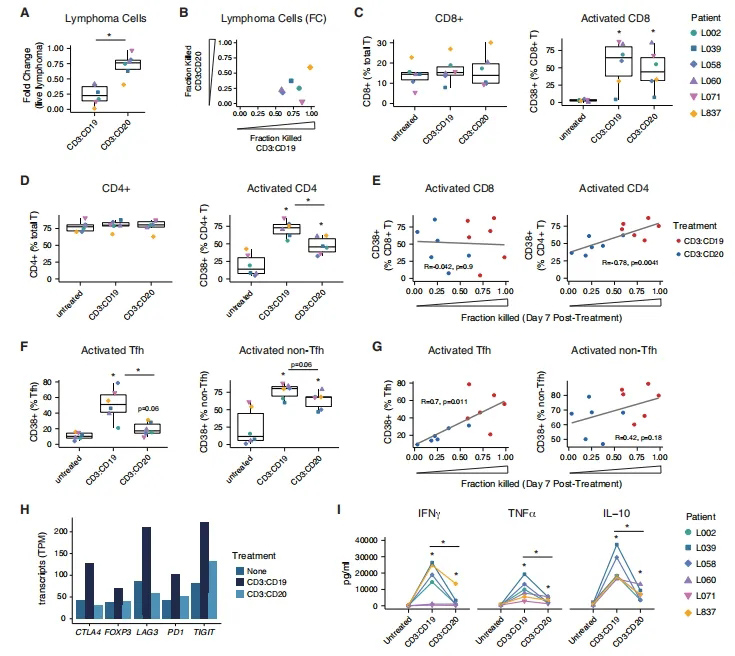
图4
03、编者点评
综上所述,本研究介绍了一种用于培养患者来源的淋巴瘤类器官(PDLOs)的培养方法,其包括原代TME的细胞。通过成功培养来自不同患者的冷冻保存的FL标本,并在3周内证明了TME细胞组成、肿瘤体细胞突变、基因表达谱和B/T细胞受体动力学的稳定性,从而确定了该体系的稳定性。
经CD19:CD3和CD20:CD3双特异性抗体处理的PDLOs具有B细胞杀伤和T细胞活化作用。这个PDLOs系统可以通过患者特异性建模、高通量筛选、TME特征识别和治疗反应评估,为推进FL的个体化精准医疗提供一个强大的平台。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特类器官平台已建立200多种斑马鱼模型及多种类器官培养平台,欢迎有需要的读者垂询!
参考文献
[1]Bachy, E., Seymour, J.F., Feugier, P., Offner, F., Lo´ pez-Guillermo, A., Belada, D., Xerri, L., Catalano, J.V., Brice, P., Lemonnier, F., et al. (2019). Sustained progression-free survival benefit of rituximab maintenance in patients with follicular lymphoma: long-term results of the PRIMA study. J. Clin. Oncol. 37, 2815–2824.
[2]Casulo, C., Dixon, J.G., Le-Rademacher, J., Hoster, E., Hochster, H.S., Hiddemann, W., Marcus, R., Kimby, E., Herold, M., Sebban, C., et al. (2022). Validation of POD24 as a robust early clinical end point of poor survival in FL from 5225 patients on 13 clinical trials. Blood 139, 1684–1693.
[3] Green, M.R., Kihira, S., Liu, C.L., Nair, R.V., Salari, R., Gentles, A.J., Irish, J., Stehr, H., Vicente-Duen˜ as, C., Romero-Camarero, I., et al. (2015). Mutations in early follicular lymphoma progenitors are associated with suppressed antigen presentation. Proc. Natl. Acad. Sci. USA 112, E1116–E1125.
[4] Scott, D.W., and Gascoyne, R.D. (2014). The tumour microenvironment in B cell lymphomas. Nat. Rev. Cancer 14, 517–534.
[5] Kridel, R., Sehn, L.H., and Gascoyne, R.D. (2012). Pathogenesis of follicular lymphoma. J. Clin. Invest. 122, 3424–3431.
[6] Rawal, S., Chu, F., Zhang, M., Park, H.J., Nattamai, D., Kannan, S., Sharma, R., Delgado, D., Chou, T., Lin, H.Y., et al. (2013). Cross talkbetween follicular Th cells and tumor cells in human follicular lymphoma promotes immune evasion in the tumor microenvironment. J. Immunol. 190, 6681–6693.
[7] Umetsu, D.T., Esserman, L., Donlon, T.A., DeKruyff, R.H., and Levy, R. (1990). Induction of proliferation of human follicular (B type) lymphoma cells by cognate interaction with CD4+ T cell clones. J. Immunol. 144, 2550–2557.
[8] Tobin, J.W.D., Keane, C., Gunawardana, J., Mollee, P., Birch, S., Hoang, T., Lee, J., Li, L., Huang, L., Murigneux, V., et al. (2019). Progression of disease within 24 months in follicular lymphoma is associated with reduced intratumoral immune infiltration. J. Clin. Oncol. 37, 3300–3309.
[9] Budde, L.E., Sehn, L.H., Matasar, M., Schuster, S.J., Assouline, S., Giri, P., Kuruvilla, J., Canales, M., Dietrich, S., Fay, K., et al. (2022). Safety and efficacy of mosunetuzumab, a bispecific antibody, in patients with relapsed or refractory follicular lymphoma: a single-arm, multicentre, phase 2 study. Lancet Oncol. 23, 1055–1065.
[10] Staerz, U.D., Kanagawa, O., and Bevan, M.J. (1985). Hybrid antibodies can target sites for attack by T cells. Nature 314, 628–631.
[11] Bargou, R., Leo, E., Zugmaier, G., Klinger, M., Goebeler, M., Knop, S., Noppeney, R., Viardot, A., Hess, G., Schuler, M., et al. (2008). Tumor regression in cancer patients by very low doses of a T cell–engaging antibody. Science 321, 974–977.
[12] Goebeler, M.E., Knop, S., Viardot, A., Kufer, P., Topp, M.S., Einsele, H., Noppeney, R., Hess, G., Kallert, S., Mackensen, A., et al. (2016). Bispecific T-cell engager (BiTE) antibody construct Blinatumomab for the treatment of patients with relapsed/refractory non-Hodgkin lymphoma: final results from a Phase I study. J. Clin. Oncol. 34, 1104–1111.
[13] Fowler, N.H., Dickinson, M., Dreyling, M., Martinez-Lopez, J., Kolstad, A., Butler, J., Ghosh, M., Popplewell, L., Chavez, J.C., Bachy, E., et al. (2022). Tisagenlecleucel in adult relapsed or refractory follicular lymphoma: the phase 2 ELARA trial. Nat. Med. 28, 325–332.
[14] Jacobson, C.A., Chavez, J.C., Sehgal, A.R., William, B.M., Munoz, J., Salles, G., Munshi, P.N., Casulo, C., Maloney, D.G., de Vos, S., et al. (2022). Axicabtagene ciloleucel in relapsed or refractory indolent nonHodgkin lymphoma (ZUMA-5): a single-arm, multicentre, phase 2 trial. Lancet Oncol. 23, 91–103.
[15] Drost, J., and Clevers, H. (2018). Organoids in cancer research. Nat. Rev. Cancer 18, 407–418.
[16] Tian, Y.F., Ahn, H., Schneider, R.S., Yang, S.N., Roman-Gonzalez, L., Melnick, A.M., Cerchietti, L., and Singh, A. (2015). Integrin-specific hydrogels as adaptable tumor organoids for malignant B and T cells. Biomaterials 73, 110–119.
[17] Purwada, A., Jaiswal, M.K., Ahn, H., Nojima, T., Kitamura, D., Gaharwar, A.K., Cerchietti, L., and Singh, A. (2015). Ex vivo engineered immune organoids for controlled germinal center reactions. Biomaterials 63, 24–34.
[18] Shah, S.B., Carlson, C.R., Lai, K., Zhong, Z., Marsico, G., Lee, K.M., Fe´ lixVe´ lez, N.E., Abeles, E.B., Allam, M., Hu, T., et al. (2023). Combinatorial treatment rescues tumour-microenvironment-mediated attenuation of MALT1 inhibitors in B-cell lymphomas. Nat. Mater. 22, 511–523.
[19] Araujo-Ayala, F., Doban˜ o-Lo´ pez, C., Valero, J.G., Nadeu, F., Gava, F., Faria, C., Norlund, M., Morin, R., Bernes-Lasserre, P., Serrat, N., et al. (2023). A novel patient-derived 3D model recapitulates mantle cell lymphoma lymph node signaling, immune profile and in vivo ibrutinib responses. Leukemia 37, 1311–1323.
[20] Roider, T., Brinkmann, B.J., Kim, V., Knoll, M., Kolb, C., Roessner, P.M., Bordas, M., Dreger, P., M€ uller-Tidow, C., Huber, W., et al. (2021). An autologous culture model of nodal B-cell lymphoma identifies ex vivo determinants of response to bispecific antibodies. Blood Adv. 5, 5060–5071.
[21] Foxall, R., Narang, P., Glaysher, B., Hub, E., Teal, E., Coles, M.C., Ashton Key, M., Beers, S.A., and Cragg, M.S. (2020). Developing a 3D B cell lymphoma culture system to model antibody therapy. Front. Immunol. 11, 605231.
