近日,云序生物联合南京医科大学第一附属医院的束永前团队将最新的研究成果,以题为“Upregulation of the long noncoding RNA FOXD2-AS1 promotes carcinogenesis by epigenetically silencing EphB3 through EZH2 and LSD1, and predicts poor prognosis in gastric cancer”发表于著名学术期刊《Oncogene》(影响因子:6.854)。该研究发现了促进胃癌进展的重要lncRNA FOXD2-AS1,并且揭示FOXD2-AS1通过EZH2和LSD1与目标基因结合而诱导转录沉默的新机制。FOXD-AS1通过EZH2和LSD1介导EphB3下调促进胃癌发生。这些结果表明在胃癌发生过程中FOXD2-AS1可以通过与EZH2和LSD1发生直接相互作用抑制EphB3发挥肿瘤诱导因子的作用,因此该分子或可成为检测癌症发生的新标志物。

研究背景:
Long noncoding RNAs (lncRNAs)是一组无蛋白编码潜能,大小超过200个核苷酸的非编码RNA。许多研究表明,lncRNA在不同的分子通路中发挥关键的调节作用,特异性的lncRNA与肿瘤的发生有关,例如FENDRR、TINCR和GAPLINC,并且在胃癌细胞中lncRNA异常富集。数据显示,多种肿瘤相关的lncRNA通过与甲基转移酶EZH2和去甲基化酶LSD1相互作用调节癌症进展。
胃癌(GC)是世界上排名第四的恶性肿瘤,在东亚地区发病率较高,大多数病例由于早期无特定的症状而被诊断为晚期。此外,由于对胃癌发生的分子和遗传机制知之甚少,治疗方案也很有限。认识到遗传和表观遗传失调与肿瘤发生有关,识别新的诊断和预后生物标志物,对预测胃癌的发生具有很好的应用前景。
研究思路:
此次云序生物和南京医科大的研究团队对FOXD2-AS1在胃癌进展中发挥的功能以及调控的相关生物学机制进行了深入研究,其思路和方法值得我们借鉴。本研究中,首先比较了GEO数据库中GC和正常胃组织的lncRNA表达谱,发现了一种新的lncRNA FOXD2-AS1在GC中显著过表达。深入分析发现FOXD2-AS1在GC中的上调与肿瘤大小、癌症发展阶段以及不良预后存在正相关关系。RACE分析和Sanger测序表明,该转录本增加了两个外显子。GO和GSEA分析显示其与细胞周期和DNA复制显著相关,FOXD2-AS1的敲除和过表达进一步验证了生信分析结果。RIP和RNA pull down结果表明FOXD2-AS1与EZH2和LSD1蛋白结合。WB结合IHC证实了FOXD2-AS1与EphB3的相关性,并且利用ChIP、qChIP和ChIRP技术结合流式细胞术以及生信分析的手段,证明FOXD2-AS1通过将EZH2和LSD1引入到EphB3的启动子中,抑制其转录。至此,成功揭示了FOXD2-AS1通过EZH2和LSD1介导的EphB3下调促进胃癌发生的新机制。
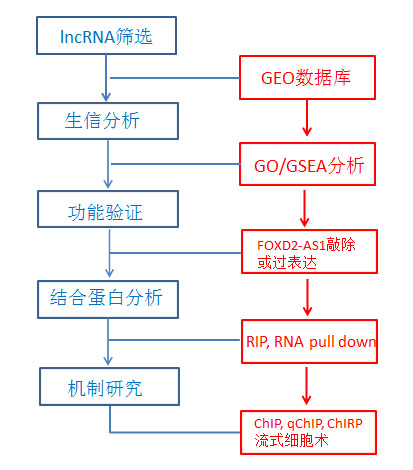
图1.技术路线图
研究内容:
1. LncRNA在GC中的表达谱
研究者利用现有芯片数据分析26对癌症和非癌组织发现lncRNAs中41个表达上调,71个表达下调,其中H19,UCA1,PVT1和FOXD2-AS1在胃癌中上调显著。为了评价lncRNA在GC中的作用,我们选择了FOXD2-AS1,显著P-Values和False discovery rate (FDR)分析表明FOXD2-AS1在GC组织中上调最为显著。RACE分析和Sanger测序揭示其全聚(A)阳性序列和基因大小(3057bp)。UCSC和CPC分析证实FOXD2-AS1没有蛋白编码能力。检测106例受试者中FOXD2-AS1的表达水平,对比癌组织/癌旁组织(T/N)比值,结果显示FOXD2-AS1在GC组织中的表达量约70%。RT-qPCR验证发现多种胃癌组织中FOXD2-AS1富集显著增加。并且FOXD2-AS1的表达水平与肿瘤大小、浸润性及肿瘤阶段呈正相关。
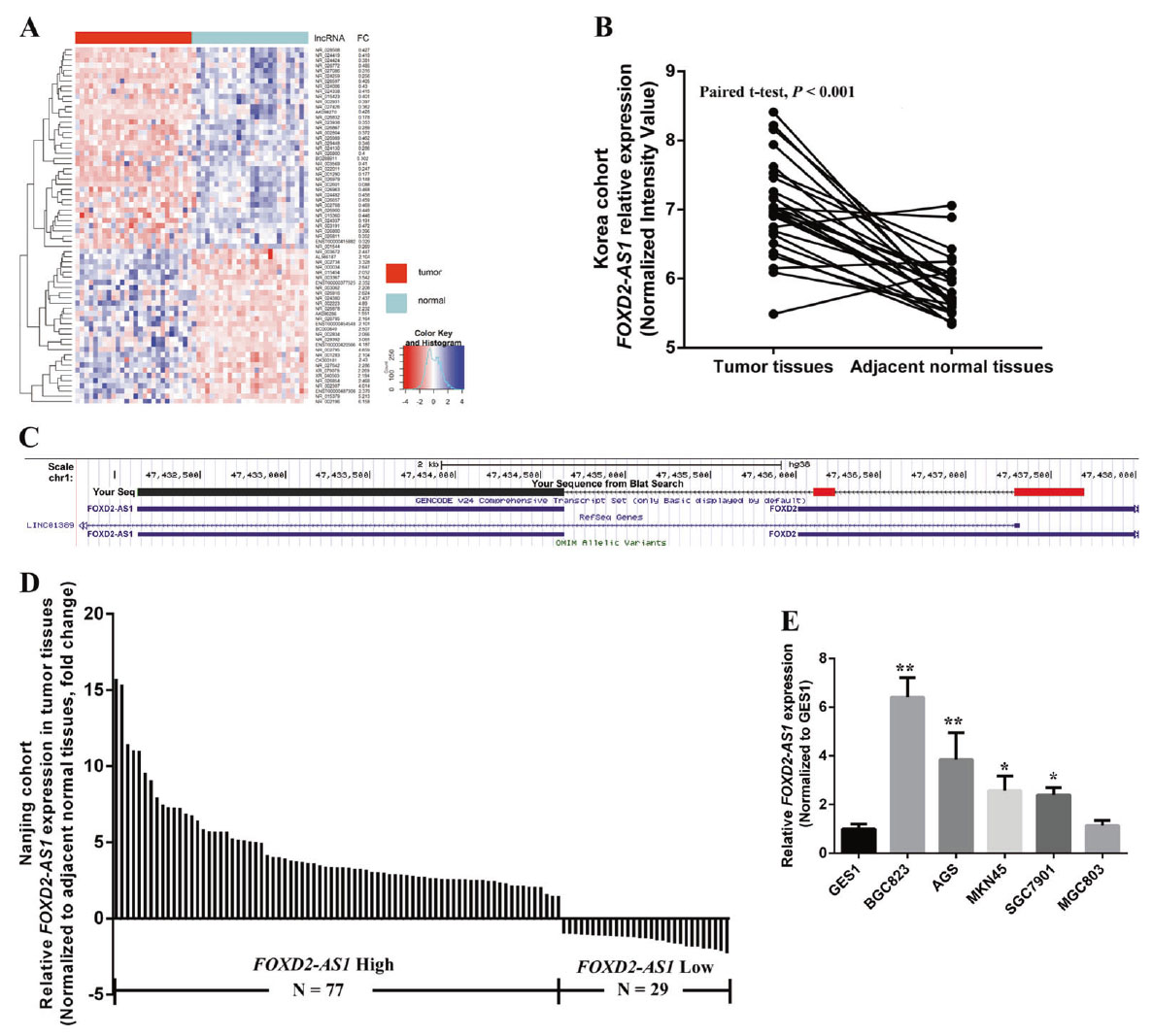
图2. GC中lncRNA表达谱分析
2. GC细胞中FOXD2-AS1富集高的患者预后较差
在芯片数据GSE51575基础上,以正常组织作为对照,来评估FOXD2-AS1的诊断效果。ROC曲线下面积为0.919(95%置信区间[CI] 0.809-0.976; P < 0.0001);特异性和敏感性分别为0.885和0.885。此外,发现区分肿瘤组织的临界值为10.925(△Ct)和AUC为0.709(95% CI 0.643 -0.769; P < 0.0001),特异性和敏感性分别为0.726和0.632。利用Kaplan-Meier (K-M)曲线和log-rank方法分析FOXD2-AS1富集与无病生存(DFS)之间的相关性,发现高富集FOXD2-AS1的患者比低富集FOXD2-AS1的患者预后差。
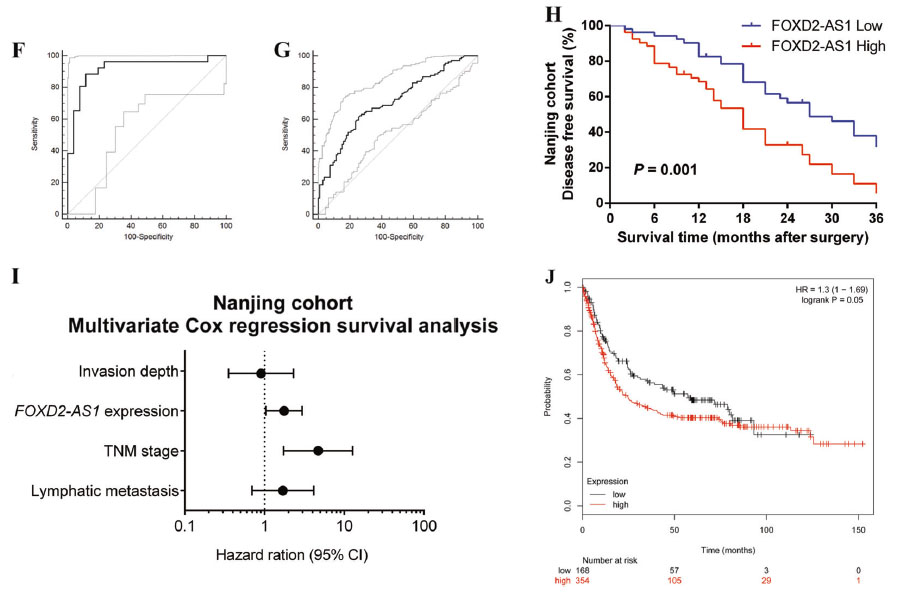
图3. FOXD2-AS1与GC患者预后关系
3. FOXD2-AS1是体外和体内的肿瘤诱导因子
为了评估FOXD2-AS1是否能促进GC进展,基于芯片数据GSE51575进行GSEA分析,结果显示,细胞周期和DNA复制两个增殖指标与高FOXD2-AS1表达组和低FOXD2-AS1表达组的基因特征最为相关。GO分析揭示了在FOXD2- AS1敲除的细胞中与细胞周期和DNA复制相关的基因的变化。此外,采用qPCR和WB检测发现FOXD2-AS1富集变化显著改变了肿瘤发生的关键基因的特征,提示FOXD2-AS1可能是胃肿瘤发生的关键调控因子。采用基因沉默和过表达的方法,揭示在裸鼠中FOXD2-AS1功能缺失能够抑制胃癌细胞的细胞周期进程,而FOXD2-AS1的表达上调能够促进癌症进展。
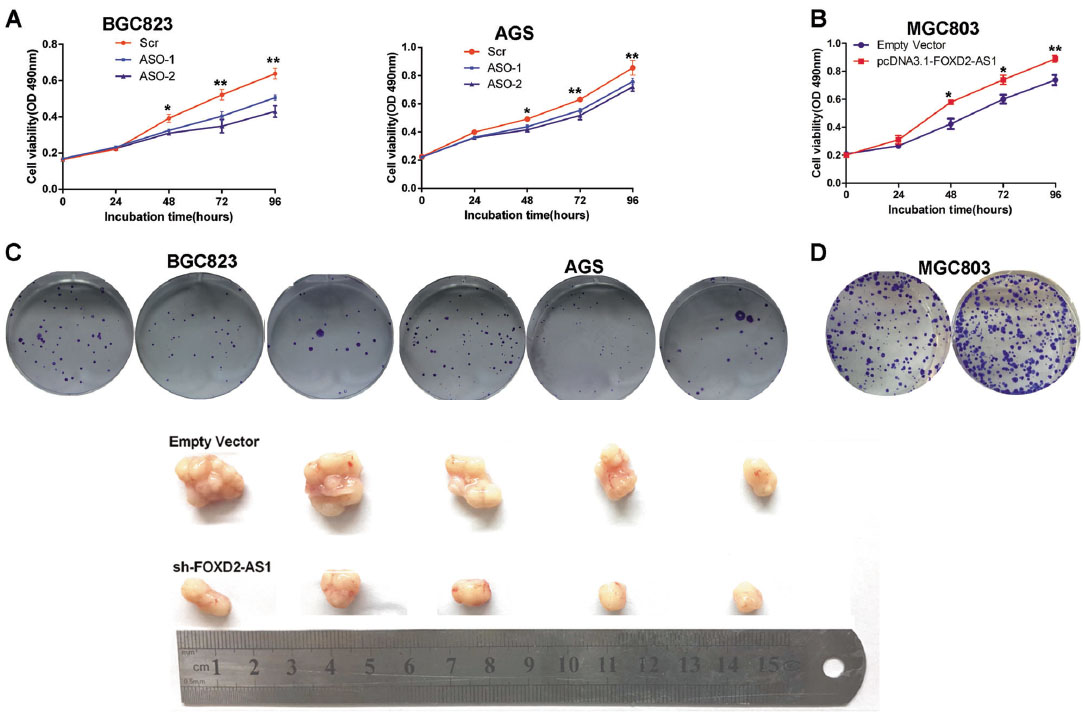
图4. FOXD2-AS1对GC进展的影响
4. FOXD2-AS1通过与EZH2、LSD1相互作用改变EphB3表达
既往研究表明,lncRNA通过RNA结合蛋白调控下游因子,是否FOXD2-AS1介导的调控同样通过类似的机制发生,研究者利用生物信息学方法结合RIP测序、RNA pull down技术最终验证了FOXD2-AS1通过与甲基转移酶EZH2和去甲基化酶LSD1的结合在GC细胞中发挥重要的调控作用。从RNA测序数据来看,FOXD2-AS1减少时,EphB3表达增加。敲除FOXD2-AS2后,发现EphB3表达显著增加,而异位FOXD2-AS1表达降低了EphB3 mRNA的富集。WB证实了FOXD2-AS1的敲除和过表达在GC细胞中分表上调和下调了EphB3的水平。为了确定FOXD2- AS1是否通过将EZH2和LSD1招募到GC中的EphB3启动子区来抑制转录,这里进行了功能的敲除和回补实验以及ChIP检测,发现EZH2和LSD1沉默后,EphB3上调。FOXD2-AS1的敲除降低了GC细胞的结合能力和诱导的修饰,而对照细胞则通过重组shRNA进行转染。为了观察FOXD2-AS1是否直接作用于靶色素,我们利用ChIRP方法分离染色质,分析了FOXD2-AS1依赖的EZH2/LSD1靶基因EphB3的位点,并使用qPCR检测。ChIRP结果显示FOXD2-AS1被招募到GC细胞的EphB3启动子中。最后,在GC组织中评估EphB3表达,与FOXD2-AS1呈反比关系,同时,FOXD2-AS1过表达导致的EphB3沉默被同时EZH2或LSD1敲除逆转。这些结果表明FOXD2-AS1可以将EZH2和LSD1引入到EphB3启动子中,抑制其转录。
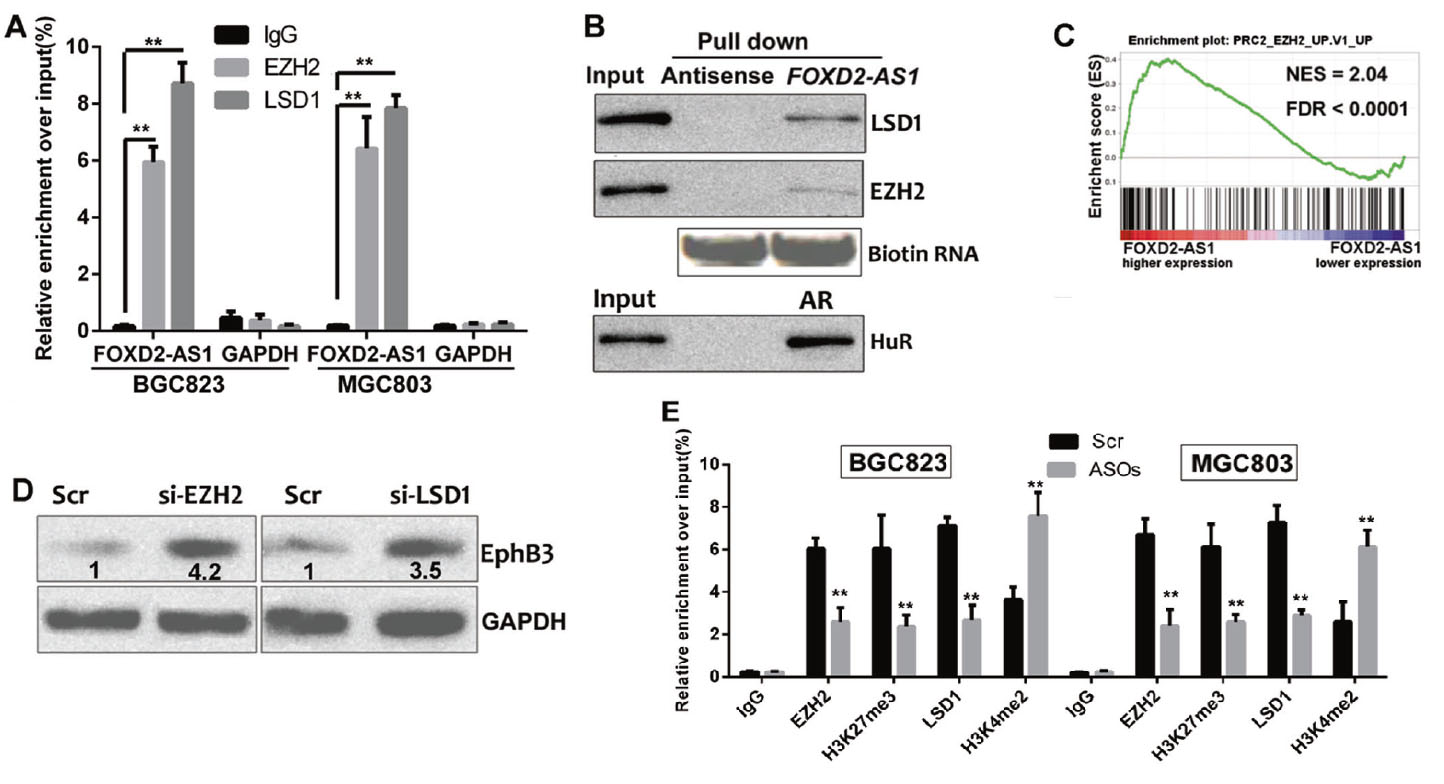
图5. FOXD2-AS1通过与EZH2、LSD1相互作用改变EphB3表达
5.促EphB3表达可抑制GC细胞增殖
数据显示,相对于正常组织,GC组织中对EphB3的富集显著降低,低的EphB3表达表明疾病进展。此外,将FOXD2-AS1与EphB3表达结合,可获得较好的预后价值。使用IHC对106个匹配的GC及周围正常组织的EphB3蛋白水平进行了评估,发现在约80%的非瘤性胃组织中,EphB3信号呈阳性,且这些肿瘤组织与周围正常组织相比,大多表现出较低的EphB3蛋白表达。此外,EphB3蛋白表达水平越低,疾病阶段越晚期。上述结果表明,低EphB3表达与GC进展有关。EphB3转染实验显示EphB3与FOXD2-AS1诱导的GC细胞增殖有关。拯救实验验证了FOXD2-AS1通过阻断EphB3表达来调控GC细胞生长。
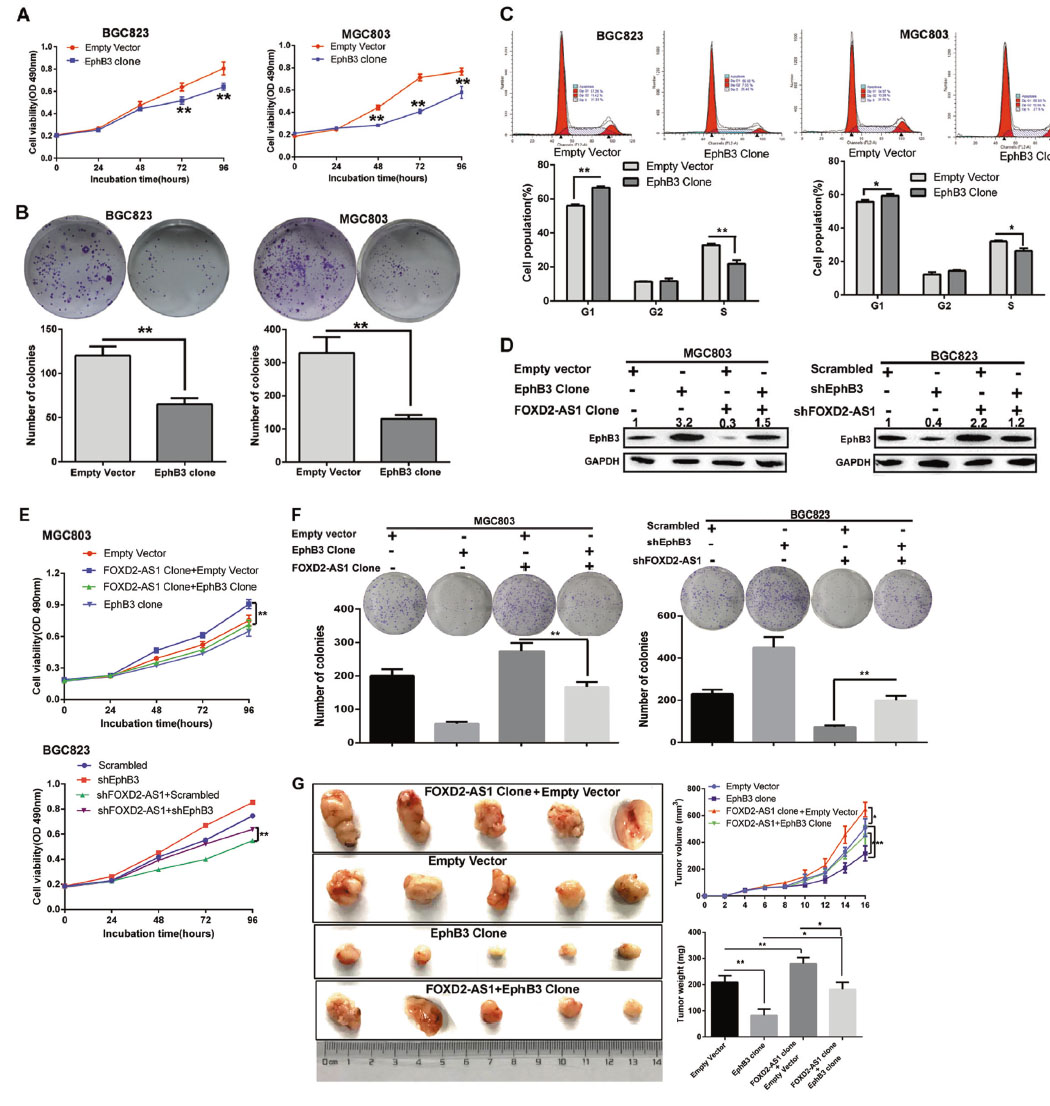
图6.促EphB3表达可抑制GC细胞增殖
总结:
云序生物&南京医科大共同发表的这篇研究成果,为胃癌发生的机制提供了全新的认识。文章揭示FOXD2-AS1可能是胃癌关键的肿瘤促进基因,并有可能成为胃癌潜在的生物标志物和治疗靶点。回顾全文,从实验设计、开展,再到数据的分析,每一个思路每一个方法都值得我们学习和借鉴,正确的选择是成功的一半,这些都离不开云序生物强大的科研团队所做出的贡献。
全文信息:
Tong-peng Xu, et al. Upregulation of the long noncoding RNA FOXD2-AS1 promotes carcinogenesis by epigenetically silencing EphB3 through EZH2 and LSD1, and predicts poor prognosis in gastric cancer. Oncogene (2018), http://sci-hub.tw/10.1038/s41388-018-0308-y
云序生物相关产品推荐:
地址:上海市松江区莘砖公路518号20号楼3楼

电话:021-64878766
传真:021-64878766
网址:www.cloud-seq.com.cn
邮箱:market@cloud-seq.com.cn
